Cours pour la 5ème sur “Les changements d’état d’un corps pur”
Chapitre 2 – Les changements d’état d’un corps pur
- MODULE 1 – La constitution de la matière
- THEME 1 : Organisation et transformations de la matière
I- Changements d’état d’un corps pur
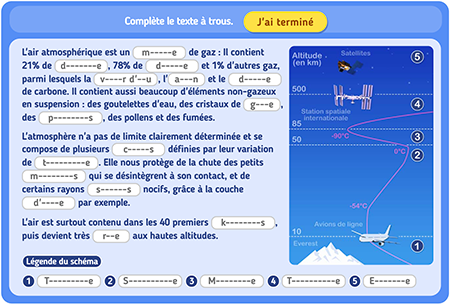
Activité documentaire : Le cycle de l’eau
- L’eau sur terre existe sous trois états physiques : l’état solide, l’état liquide et l’état gazeux.
- L’eau peut passer d’un état physique à un autre.
- En effet, sous l’action de la chaleur du Soleil, l’eau par exemple des océans ou des lacs se transforme en un gaz invisible appelée vapeur d’eau : on parle de vaporisation.
- Au contraire, en se refroidissant, la vapeur d’eau peut repasser à l’état liquide : on parle de liquéfaction.
- En refroidissant l’eau liquide, elle peut passer à l’état solide : on parle de solidification.
- Si on réchauffe la glace, elle redevient de l’eau liquide : on parle de fusion.
II- Volume et masse lors d’un changement d’état
Vidéo : Volume et masse lors de la solidification
- Lors d’un changement d’état, la masse ne varie pas. Elle reste constante. Cela est dû au fait que le nombre de particules de matière reste le même.
- Lors de la solidification, le volume de l’eau augmente. Cependant, pour la plupart des autres corps, le volume diminue lors de la solidification. Cela est dû à l’arrangement spatial que prennent les particules, elles ont tendance à se rapprocher.
III-Fusion de la glace
Activité expérimentale : A quelle température la glace fond-elle ?
- Si on laisse un glaçon dans l’air ambiant, il finit par fondre.
- Le suivi de l’évolution de la température de la glace au cours du temps permet d’obtenir une courbe appelée courbe de fusion de la glace. Elle présente trois parties :
Partie 1 : dans l’air ambiant, la température de la glace augmente.
Partie 2 : à 0 °C, la glace commence à fondre mais la température reste constante. La courbe présente un palier de température tant que toute la glace ne s’est pas transformée en eau liquide.
Partie 3 : lorsque la glace a totalement disparu, la température augmente à nouveau.
- La fusion de la glace s’effectue à température constante et est égale à 0 °C. L’énergie reçue pendant la fusion ne sert qu’au changement d’état.
IV- Ébullition de l’eau
Activité expérimentale : L’eau bout -elle toujours à la même température ?
- La température d’ébullition de l’eau dépend de la pression(voir Module 1 – Ch5) :
- Lorsque la pression est égale à la pression environnante de l’air, la température d’ébullition de l’eau est de 100 °C.
- Lorsque la pression diminue, la température d’ébullition de l’eau
- Lorsque la pression augmente, la température d’ébullition de l’eau
- La courbe de vaporisation de l’eau pure présente deux parties :
Partie 1 : une augmentation de la température de l’eau dû à l’apport d’énergie par le chauffage.
Partie 2 : A 100°C, l’eau commence à se transformer en vapeur mais la température reste constante. On retrouve un palier de température tant que toute l’eau ne s‘est pas transformée en vapeur d’eau.
Remarque : La température d’ébullition d’un mélange augmente pendant toute la durée du changement d’état : il n’y a donc pas de palier de température.
La vaporisation de l’eau s’effectue à température constante et est égale à 100°C sous pression atmosphérique habituelle (1013 hPa).
Dans ce chapitre 2 consacré aux changements d’état d’un corps pur, vous trouverez également :
- Feuille d’exercices avec les corrections
- Activité expérimentale : L’eau bout-elle toujours à la même température ?
- Activité expérimentale : A quelle température la glace fond-elle ?
- Activité documentaire : Le cycle de l’eau